自疫情爆发以来,网上被问到最多的问题——
各地减毒株都分离完成了,疫苗什么时候上市?
疫苗到底是怎么研发出来的?
请跟随小编一起看看,疫苗研发的那些事。
1976年英国医生琴纳率先成功接种牛痘苗预防人类天花,自此疫苗接种被认为是预防各种细菌和病毒感染的最佳选择。传统的策略是制备灭活疫苗,即利用被杀灭的病毒或其裂解片段刺激健康人体的免疫系统,产生针对性抗体,达到预防疾病目的。
近年来,随着组学和生物信息学技术的不断突破,反向疫苗学(利用基因组或基因序列寻找和设计合适的疫苗)成为国际上最为常用的策略,广泛用于多种动物传染性疾病的疫苗研制。人们首先通过基因组学技术分析病原体的核酸序列,然后利用生物信息学分析序列中表达的生物学信息,从中筛选出合适的候选抗原,进而研制出有效的疫苗。
随着人类基因组计划完成,生命科学领域重心转移到基因表达产物-蛋白质水平上,开启了蛋白质组学为首的后基因组时代。结合基因组学,比较疾病和健康的样本、药物处理和未处理样品、诱变和未被诱变的样本,筛选病原生物的有效疫苗候选分子,已成为微生物学家及医学科研者的研究热点。请随小编一起来看看,科研人员是如何利用组学技术助力疫苗相关研发的!
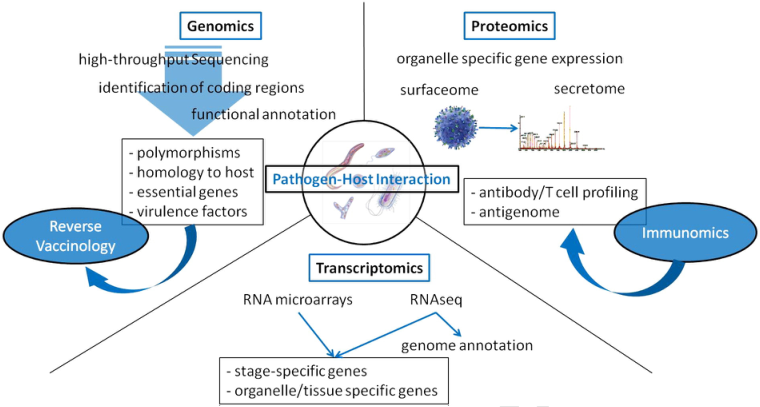
(源于Biotechnology Advances, 2014, 32(2):403-414.)
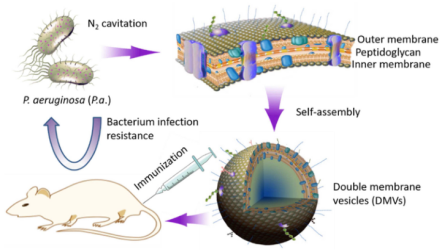
1. Biomaterials丨蛋白组学辅助氮空化法技术进行制备疫苗
A Facile Approach for Development of a Vaccine Made of Bacterial Double-layered Membrane Vesicles (DMVs)【IF:10.273 】
本文报道了一种通过氮空化技术对细菌膜形成纳米囊泡疫苗的快速制备方法。首先将菌体 (Pseudomonas aeruginosa) 通过氮空化技术进行破碎、离心得到双层膜囊泡(DMVs)。接着、作者使用基于LC-MS/MS的蛋白质组学方法对所获DMVs的蛋白组成进行分析,证实DMVs具有细菌膜的完整性并包含多种疫苗所需的膜蛋白,可作为候选疫苗(在DMVs和P. aeruginosa分别鉴定到502和698种蛋白,其中394为共有蛋白,并且与外膜蛋白组成相近,均以OprF、OprH/G和AtpF/OprL为主)。为进一步验证该方法获取疫苗的可行性,作者利用P. aeruginosa诱导的脓毒症小鼠模型,证实DMVs可有效激活细菌感染防御过程中所需的天然免疫和适应性免疫,促进B细胞和T细胞活化,显著降低促炎细胞因子 (IL-1β、TNF-α和IL-6),提高小鼠免疫后的存活率。DMVs所具有的适应性免疫增强及其独特的生物分布 (主要位于脾脏和肝脏) 均有利于增强对细菌感染过程中的保护作用,上述结果均证实氮空化法在疫苗开发中具有广阔的应用前景。
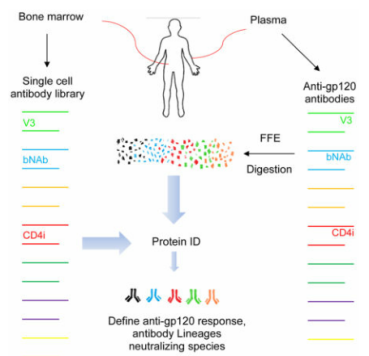
2. CELL丨通过蛋白组学鉴定抗HIV-1的近泛中和抗体
Identification of Near Pan-Neutralizing Antibodies Against HIV-1 by Deconvolution of Plasma Humoral Responses【 IF:36.216】
本文作者利用基因组和蛋白组学技术对骨髓细胞来源的抗HIV的广泛中和抗体进行分析,构建循环多克隆抗gp120反应中的中和抗体谱系。1)富集来自N60 (在无药物治疗条件下可以控制艾滋病毒复制的HIV感染者) 血清中广泛中和IgG组分,利用LC-MS/MS技术解析不同质量肽段的氨基酸序列,进而鉴定Ig H和L链基因。2)将15对H和L基因的Fab序列与IgG1 (血浆广泛中和抗体所属亚型) 构建单克隆抗体(mAb)过表达质粒,使用自由流等电聚焦的方法验证其与血浆抗体的氨基酸序列一致。3)进一步分析发现,所有抗gp120 mAb序列均可在骨髓CD138-和CD138+中检测到,其中两种mAbs (N60P1.1和N60P25.1) 显示出超强的中和活性,与亲和纯化血浆Ig的匹配度达70%和73%;所获各谱系中的mAbs可中和89%-100%的受试病毒 (共117株),与循环抗体相近。4)作者最终对筛选后mAbs进行X射线晶体结构分析,明确其产生广泛的抗病毒效应原因。以上研究为病毒及疫苗研发提供新思路。
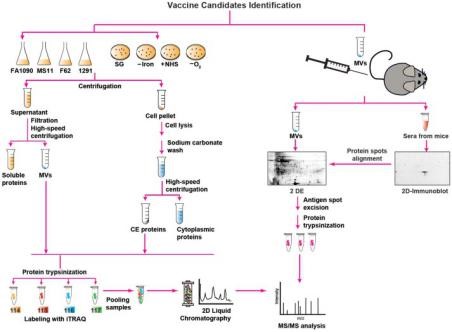
3. Frontiers in Immunology丨蛋白组学、生物信息学以及蛋白结构与功能分析助力淋病疫苗开发
Proteomics, Bioinformatics and Structure-Function Antigen Mining For Gonorrhea Vaccines 【 IF:4.716 】
本研究利用基于定量蛋白质组学技术的反向疫苗法进行淋病疫苗开发。首先,作者对4种不同的Neisseria gonorrhoeae菌株进行培养,在对数生长中期分离提取膜泡 (MV) 和细胞 (CE) 蛋白,使用iTRAQ蛋白质组学技术 (结合2D-LC预分离)分析,在4株菌系的CE和MV中分别鉴定得到533和168种蛋白。接着,为筛选不同宿主微环境中潜在抗原,作者构建不同的培养体系 (好氧、厌氧、铁缺乏等)、 并进行iTRAQ蛋白质组学分析,从中挖掘CE和MV中普遍存在、且差异表达的关键蛋白(如SliC、Slam2、NGO1688)。进一步地,通过经典的免疫蛋白质组学方法鉴定可能的交叉反应抗原,结合生物信息学分析 (功能分析、亚细胞定位、翻译后修饰等) 预测潜在抗原,并提出构建系统性候选疫苗决策树的完整方法。最后,作者对新发现的毒力因子C型溶菌酶抑制剂SliC的功能及活性进行分析,揭示候选疫苗在细菌致病过程中的重要作用。
小编小结:近年来,技术不断革新极大地促进了病原体基因组注释及新基因和蛋白产物的鉴定,助力从基因到疫苗的开发。其中,蛋白组学是解析病原体生物学功能的有效手段,如表面抗原亚群及阶段特异性蛋白的鉴定。对于疫苗相关研究而言,可首先通过免疫亲和的方式 (如使用单克隆抗体) 将病毒多肽从MHC (Major histocompatibility complex) 肽段复合物中分离并洗脱,再使用LC-MS/MS对不同肽段组分进行鉴定,对于上述过程锁定到的关键病毒肽段可进一步使用LC-MRM的方法对其进行靶向的绝对定量分析。通过结合免疫学 (如免疫表位学) 研究筛选潜在候选疫苗。
