 胰腺癌(PDA)是一种致命的恶性肿瘤,5年生存率为11%。由于胰腺癌中存在广泛的肿瘤微环境(TME),即便使用最为新的免疫疗法,患者的最终治愈率依然低下。先前的报道显示,胰导管腺癌的发生与WNT信号的激活有关,但是信号通路的激活与肿瘤微环境之间的调控关系尚不清楚。来自美国密歇根大学的研究团队在Journal of Experimental Medicine(IF 17.579)上发表题为“WNT signaling in the tumor microenvironment promotes immunosuppression in murine pancreatic cancer”的文章。该文章应用单细胞转录组测序技术对胰腺癌样本进行检测,系统的解析了表达Tcf7的CD4+T细胞通过调控肿瘤微环境的改变,引起PD-L1+细胞的代偿性增加。然后,作者在动物模型中,使用WNT信号抑制剂联合靶向PD-L1治疗方案,成功降低了胰腺癌的生长。这一研究成果也为临床治疗胰腺癌提供了新的指导方案。
胰腺癌(PDA)是一种致命的恶性肿瘤,5年生存率为11%。由于胰腺癌中存在广泛的肿瘤微环境(TME),即便使用最为新的免疫疗法,患者的最终治愈率依然低下。先前的报道显示,胰导管腺癌的发生与WNT信号的激活有关,但是信号通路的激活与肿瘤微环境之间的调控关系尚不清楚。来自美国密歇根大学的研究团队在Journal of Experimental Medicine(IF 17.579)上发表题为“WNT signaling in the tumor microenvironment promotes immunosuppression in murine pancreatic cancer”的文章。该文章应用单细胞转录组测序技术对胰腺癌样本进行检测,系统的解析了表达Tcf7的CD4+T细胞通过调控肿瘤微环境的改变,引起PD-L1+细胞的代偿性增加。然后,作者在动物模型中,使用WNT信号抑制剂联合靶向PD-L1治疗方案,成功降低了胰腺癌的生长。这一研究成果也为临床治疗胰腺癌提供了新的指导方案。
研究材料
16个样本的PDA患者单细胞转录组数据集(PDA组织和配对的血液样本)
3个样本的小鼠的单细胞转录组(组织样本)
技术路线
步骤1:单细胞转录组验证了Tcf7在人和小鼠PDA的CD4+ T细胞中的保守性;
步骤2:敲除Tcf7可以通过抑制CD4+T细胞的免疫功能改变肿瘤微环境;
步骤3:敲除Tcf7可以调控PD-L1+髓细胞细胞代偿性的增加;
步骤4:实验验证了抑制WNT信号通路对PDA的治疗效果。
研究结果
1. 单细胞转录组验证了Tcf7在人和小鼠PDA的CD4+ T细胞中的保守性
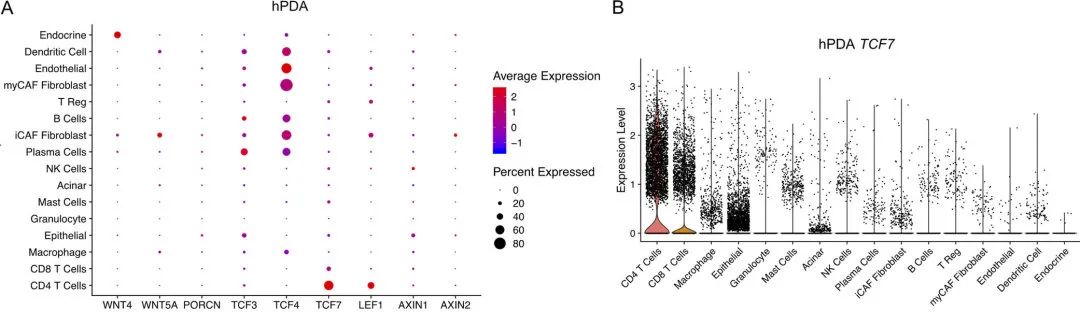
 图1 Tcf7在人和小鼠PDA的CD4+ T细胞中普遍存在
图1 Tcf7在人和小鼠PDA的CD4+ T细胞中普遍存在 2. 敲除Tcf7可以通过抑制CD4+T细胞的免疫功能改变肿瘤微环境
TCF1最初被认为是T淋巴细胞特异性转录因子,在T细胞的发育和分化中起着关键作用。因此,基于单细胞的数据分析结果,作者设想TCF1在PDA中具有调节CD4+ T细胞的免疫抑制功能。接下来,作者设计了Tcf7敲除模型。经过一段时间培养后,发现敲除小鼠的肿瘤生长显著降低。通过IHC和流式分选等实验进一步验证了CD4+ T细胞的免疫抑制功能可能由TCF1介导。上述的实验结果显示出了Tcf7在调控CD4+T细胞改变肿瘤微环境的重要作用。
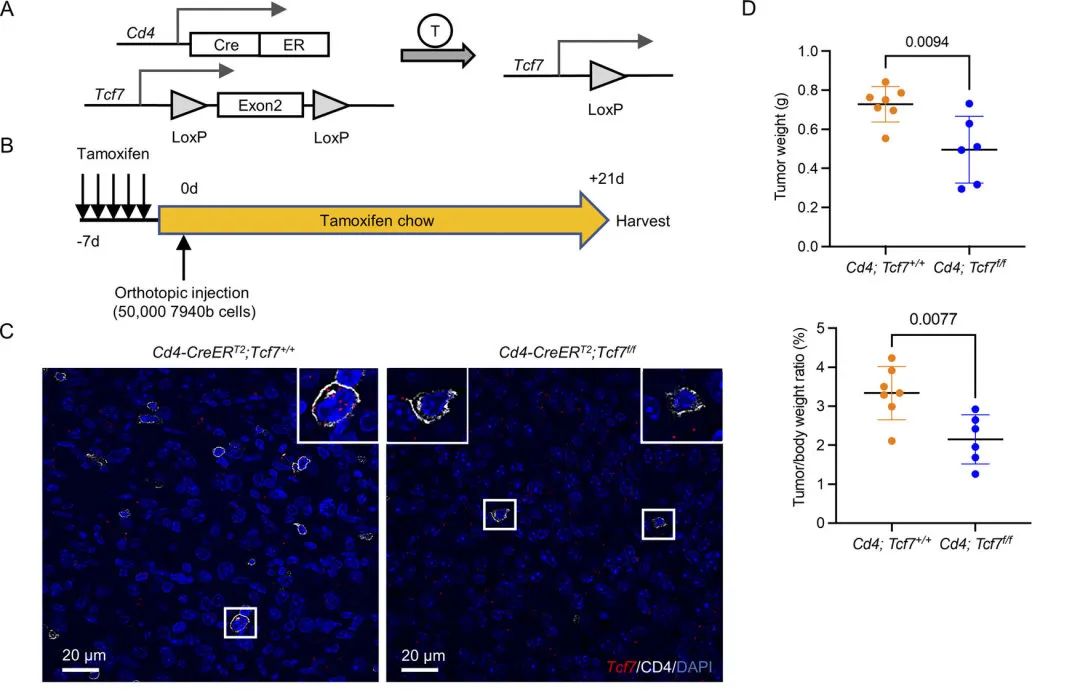
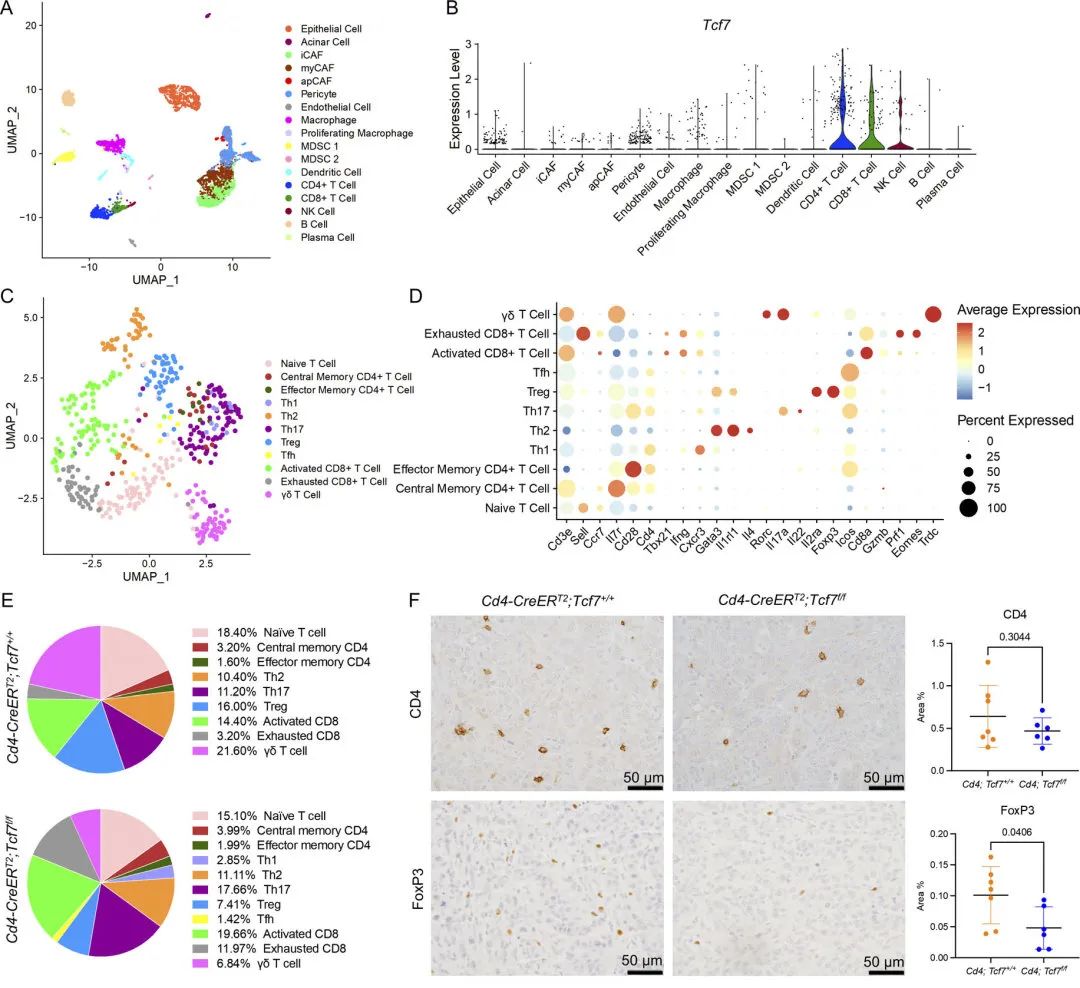 图3 CD4+ T细胞中的TCF1信号通路促进PDA中的Treg分化
图3 CD4+ T细胞中的TCF1信号通路促进PDA中的Treg分化 3. 敲除Tcf7可以调控PD-L1+髓细胞细胞代偿性的增加
接下来,为了确定CD4+ T细胞中Tcf7的失活是否改变了PDA TME中髓系细胞的组成,作者对髓系细胞进行了亚群再聚类,共鉴定出6种细胞类型,发现不同的细胞在两组模型中的变化显著。然后作者研究了髓系细胞免疫抑制的潜力,然而不同的髓系细胞亚群在两组间的Cd274(PD-L1)表达水平相似,但是Arg1和Nos2的表达水平在敲除组中更高。这些结果提示了敲除Tcf7导致了免疫抑制表型增强。这一结果与作者之前观测到的结果相吻合。随后,作者通过质谱流(CyTOF)技术再次验证了这一结果,同时发现在CyTOF的结果中,Tcf7敲除组的PD-L1的髓系细胞数量增加。因此,作者推测PD-L1+细胞的增加是否可以作为治疗胰腺癌的靶点。
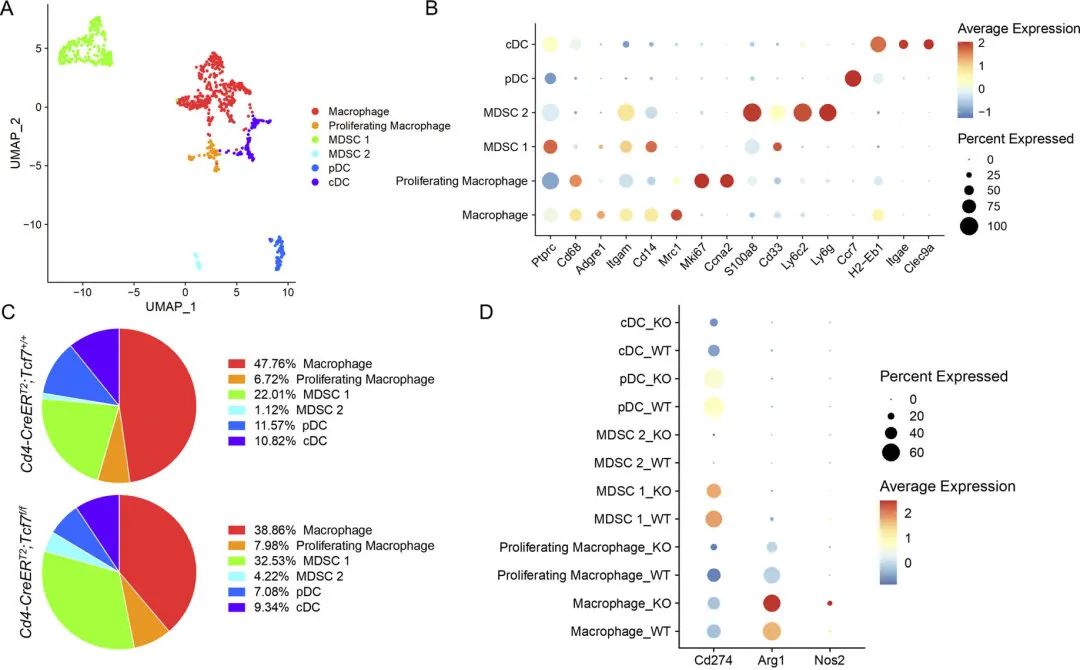
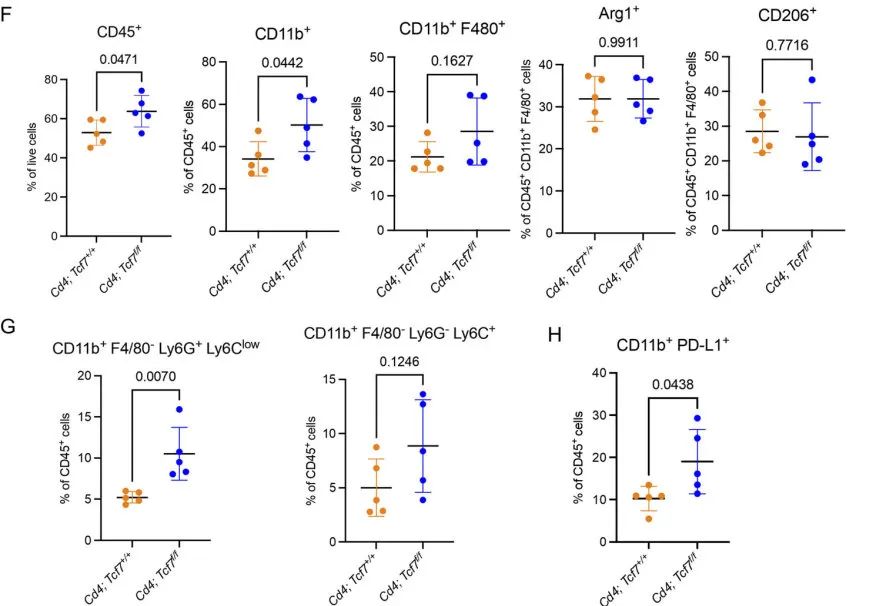 图4 CD4+ T细胞中TCF1的缺失导致MDSCs的代偿性增加
图4 CD4+ T细胞中TCF1的缺失导致MDSCs的代偿性增加先前的报道显示,在一些肿瘤中存在IL-17与PD-L1的表达相关。因此,作者在骨髓来源的髓系前体细胞(BMDMs)上测试了IL-17是否调节PD-L1的表达。结果发现,IL-17A会导致Cd274、Arg1和Nos2的高表达。然而这一结果却没能在PDA模型的细胞系中重现。随后,作者设计了细胞共培养实验,证实了TCF1缺失的CD4+ T细胞能够诱导肿瘤细胞中PD-L1的表达。
 图5 CD4+ T细胞中TCF1的缺失驱动髓细胞和肿瘤细胞中PD-L1的表达
图5 CD4+ T细胞中TCF1的缺失驱动髓细胞和肿瘤细胞中PD-L1的表达 4. 实验验证了抑制WNT信号对PDA的治疗效果
作者先前的数据表明了WNT通路在上皮细胞中参与对肿瘤的支持作用。作者设计使用能够抑制WNT信号通路的PORCN抑制剂(PORCNi),将小鼠随机分为对照组或PORCNi组。结果发现PORCNi治疗后的小鼠肿瘤更小。然后,作者通过流式细胞术评估了WNT信号的抑制作用是否改变了肿瘤的微环境。结果观察到在PORCNi治疗后的小鼠中Total T细胞和CD8+ T细胞浸润的增加。随后,作者又通过抗CD8和抗PD-L1进行功能验证,发现抑制WNT信号可以使PDA对PD-L1阻断敏感,表明联合靶向可以降低胰腺癌的生长,并可能有益于胰腺癌的治疗。
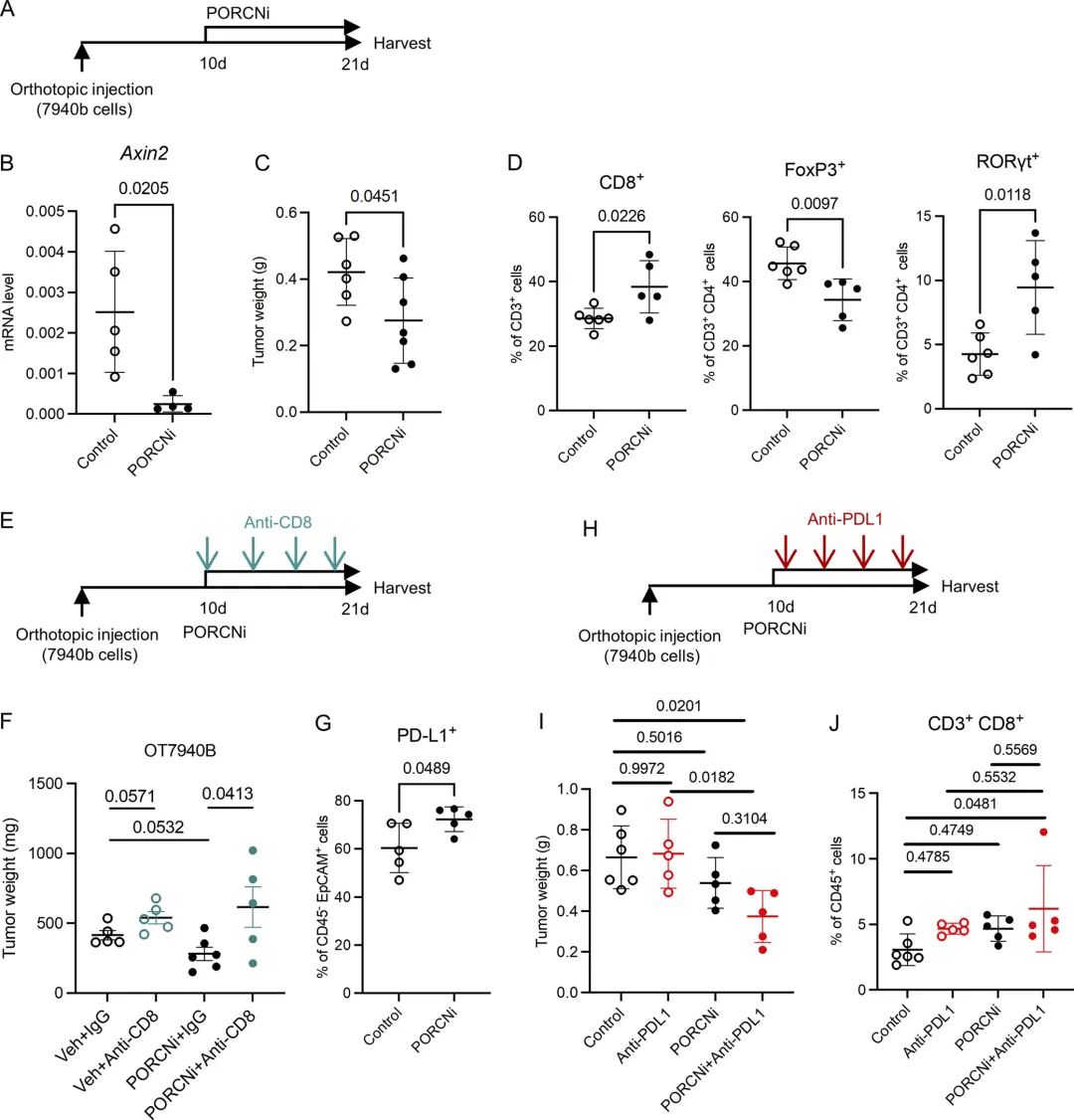 图6 抑制WNT信号可以提高了PD-L1阻断的疗效
图6 抑制WNT信号可以提高了PD-L1阻断的疗效小编小结
作者在先前大量的研究中报道了WNT信号在上皮细胞和CD4+ T细胞中具有活性,并有助于阻断CD8+ T细胞的抗肿瘤活性。因此,在本次研究内容中,作者采用单细胞转录组测序技术对PDA患者和模型小鼠的胰腺癌肿瘤组织进行检测,详细的描述了CD4+ T细胞中Tcf7的失活以特异性的方式抑制WNT信号,从而激活 CD8+ T细胞效应功能来抑制肿瘤进展。但是表达PD-L1的肿瘤细胞和髓系细胞的数量也得到代偿性增加。通过药物抑制在肿瘤细胞和CD4+ T细胞中抑制WNT信号,联合PD-L1治疗可以有效抑制肿瘤生长。这一研究成果或许可以为胰腺癌的临床治疗提供新的解决方案。
中科优品推荐
【中科新生命】重点布局单细胞多组学平台,先后建立了基于10x Genomics 最为新Chromium X的单细胞转录组测序平台以及“一站式”单细胞蛋白质组服务平台。其中,Chromium X作为当前业内通量最高的单细胞测序平台之一,可以实现百万级细胞通量检测,为大规模单细胞图谱、高通量药物筛选、稀有细胞鉴定分析等需求提供助力。
